肠道病毒71型(Enterovirus 71🏉🧉,EV-A71)为嗜神经性病毒,属于小RNA病毒科肠道病毒属👨🏽🦰,是手足口病(Hand,foot and mouth disease,HFMD)的主要病原体之一[1]➡️。手足口病是一种全球性疾病🏃,部分患者可引起多种中枢神经系统并发症🦹,甚至致命性死亡[2, 3]。然而,目前还没有临床获批的针对EV-A71的抗病毒药物。肠道病毒与宿主因子的研究尚不完全明确,揭示关键宿主因子的作用机制研究可能为肠道病毒特异性药物的研发提供重要线索。
宿主蛋白激酶介导的细胞信号传导在许多病原体的复制和繁殖中发挥重要作用。先前杏鑫平台王鹏飞团队和香港大学周婕团队合作于Journal of Medical Virology在线发表了题为 “Rock1 is a novel host dependency factor of human enterovirus A71: implication as a drug target”的研究论文⬛️,揭示了Rock1是EV-A71复制的新型宿主依赖因子,可作为开发抗EV-A71疗法的靶标。近日,杏鑫平台的王鹏飞/赵晓宇团队在国际学术期刊Journal of Virology上发表题为“Vascular endothelial growth factor receptor 2 as a potential host target for the inhibition of enterovirus replication”的研究论文,发现帕唑帕尼(Pazopanib)具有广谱抗肠道病毒的作用,并揭示VEGFR2可能是肠道病毒复制的潜在宿主依赖因子,可作为开发抗肠道病毒疗法的靶标。

研究人员前期利用横纹肌肉瘤(RD)细胞和二维肠道肠道类器官(2D intestinal organoids)筛选激酶数据库◾️,研究发现血管内皮生长因子受体(Vascular endothelial growth factor receptor,VEGFR)家族的19个靶向性抑制剂💁♀️,均表现出有效的抗病毒活性。基于此☂️👩🦽,研究人员推测VEGFR家族中可能含有肠道病毒复制和繁殖所需的关键宿主因子🫷🏻。其中,通过病毒减少实验(Viral reduction assay),从病毒基因拷贝数、活病毒滴度以及免疫荧光染色等方面,证明了Pazopanib对EV-A71的抑制作用呈现剂量依赖性效果(图1),其选择性指数高达254,甚至比已知有效的广谱微小RNA病毒抑制剂吡罗达韦(Pirodavir)还要高出许多♻️。
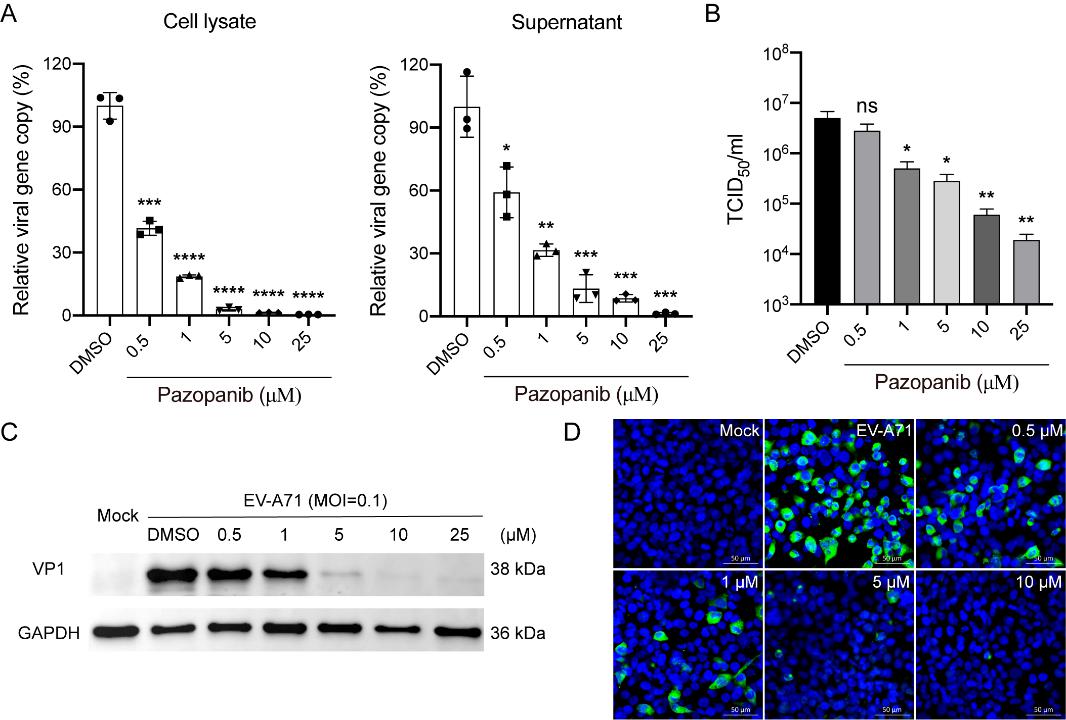
图1 Pazopanib在RD细胞中对EV-A71的剂量依赖性抑制作用
同时🛅,通过多种经典病毒学实验证实Pazopanib能够在体外抑制多轮病毒的复制⤵️,并在感染早期抑制病毒结构蛋白VP1的表达🤢⚾️。此外🧑🏼🍳,Pazopanib能够抑制EV-A71在多种细胞中的复制,包括Huh-7、HepG2🌩、Caco-2、HT-29🥬、HEK-293T和Vero-E6细胞🕴🏼。并且🪶,在Pazopanib的存在下🦶🏼,EV-A71介导的IL-6🗯、IL-8和TNF-α诱导明显减弱,提示Pazopanib可以抑制病毒诱导的促炎反应。随后,研究人员发现Pazopanib对不同亚型肠道病毒的具有广谱抗病毒效果🚻,包括Enterovirus A的柯萨奇病毒A10型🏚,Enterovirus B的柯萨奇病毒B1型,Enterovirus D的肠道病毒70型🥃,以及人类鼻病毒A型💺,表明Pazopanib具有成为抗多种肠道病毒的广谱抗病毒药物的潜在价值(图2)🫏。接下来👩💻,研究人员通过药物添加时间测定等实验🪘,初步判断Pazopanib可能诱导宿主细胞的某些改变,从而阻碍病毒基因组复制和转录🦄,而不是通过影响受体结合或抑制靶向病毒功能蛋白(如蛋白酶或聚合酶)的进入🦹🏻。
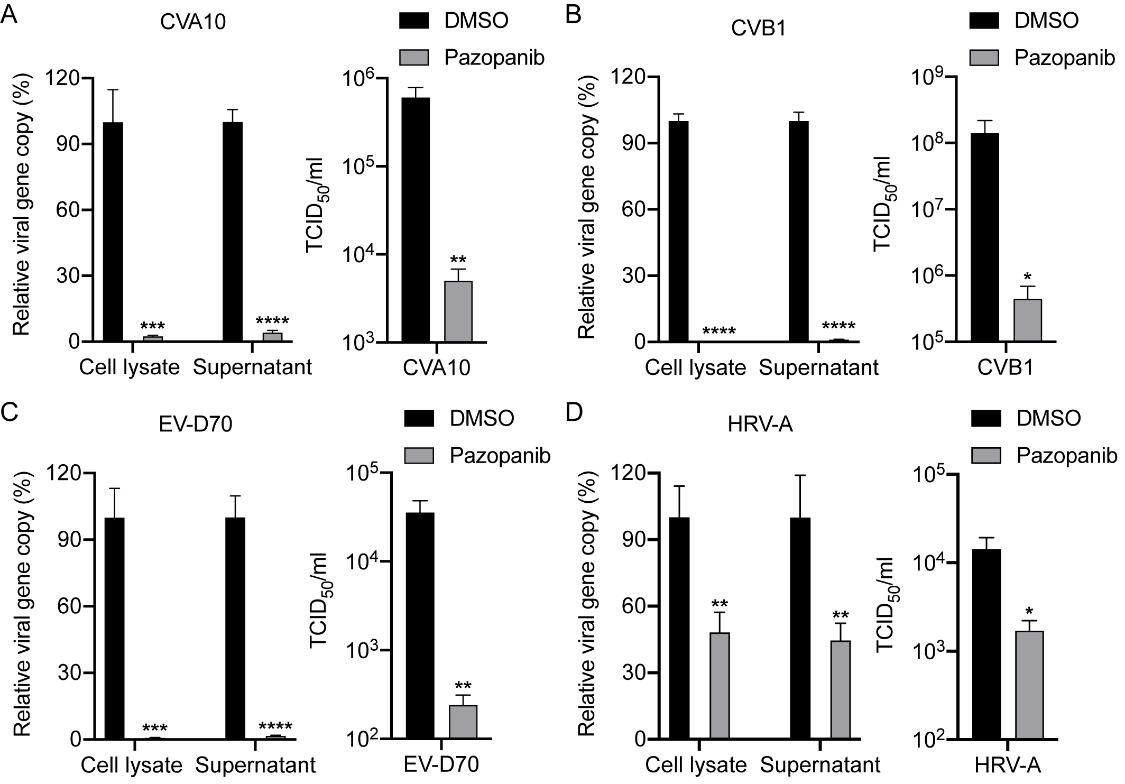
图2 Pazopanib广谱抑制多种肠道病毒的感染
值得注意的是,血管内皮生长因子(VEGF)其家族包含VEGFR1、VEGFR2和VEGFR3三个受体🛍。然而🧔🏿♂️,由于 Pazopanib靶向所有亚型,因此参与 EV-A71 复制的特定基因仍未确定🎀。因此🚦,研究人员首先检测了 EV-A71 感染后 RD 细胞中 VEGFR 的 mRNA表达情况🧘🏿。研究发现,在8和24 hpi 时🤹🏿♀️,VEGFR2 的 mRNA 表达水平均显著上调,但 VEGFR1 和 VEGFR3 的 mRNA 表达水平没有显著上调👰🏻,这表明在 EV-A71 感染期间VEGFR2被激活。接下来🚶🏻♂️➡️,通过小干扰RNA(siRNA)分别敲低以上三个受体基因进一步发现只有VEGFR2基因敲低的细胞会显著降低EV-A71病毒的复制。同时👬🏻,过表达VEGFR2蛋白则增加了EV-A71在细胞中的复制,从而确定VEGFR家族中参与EV-A71复制和繁殖所需的关键宿主因子为VEGFR2(图3)🧝🏻♀️。
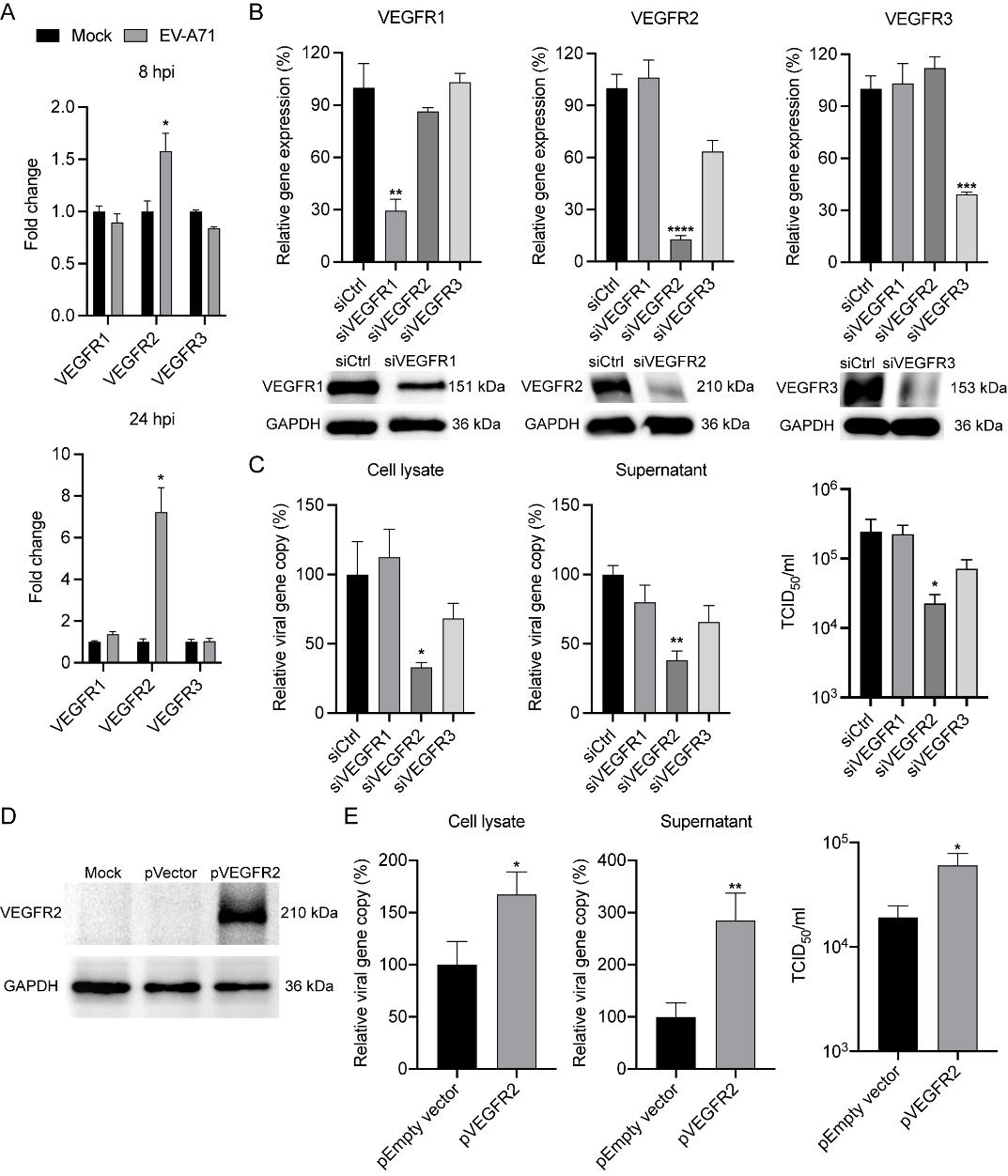
图3 VEGFR2是EV-A71复制的潜在关键宿主因子
最后,通过转录组学及KEGG分析差异表达基因(DEGs)进一步探究Pazopanib的存在对EV-A71感染后的RD细胞内宿主因子的改变⇾。研究发现,这些DEGs都与PI3K-Akt信号通路有关,表明Pazopanib可能通过调节下游PI3K-Akt信号通路发挥其抗病毒作用(图4)🧝🏽。随后🧏♂️,使用Src抑制剂Dasatinib和Akt选择性抑制剂MK-2206均能够显著抑制病毒EV-A71的复制,而EV-A71感染后导致的Akt磷酸化同样能被Pazopanib抑制。更重要的是,免疫印迹实验表明,EV-A71感染HUVEC后😛,会诱导磷酸化VEGFR2的增加。这些发现表明,VEGFR2可能是通过激活TSAd-Src-PI3K-Akt 信号通路影响EV-A71的感染⏩🤦🏽。
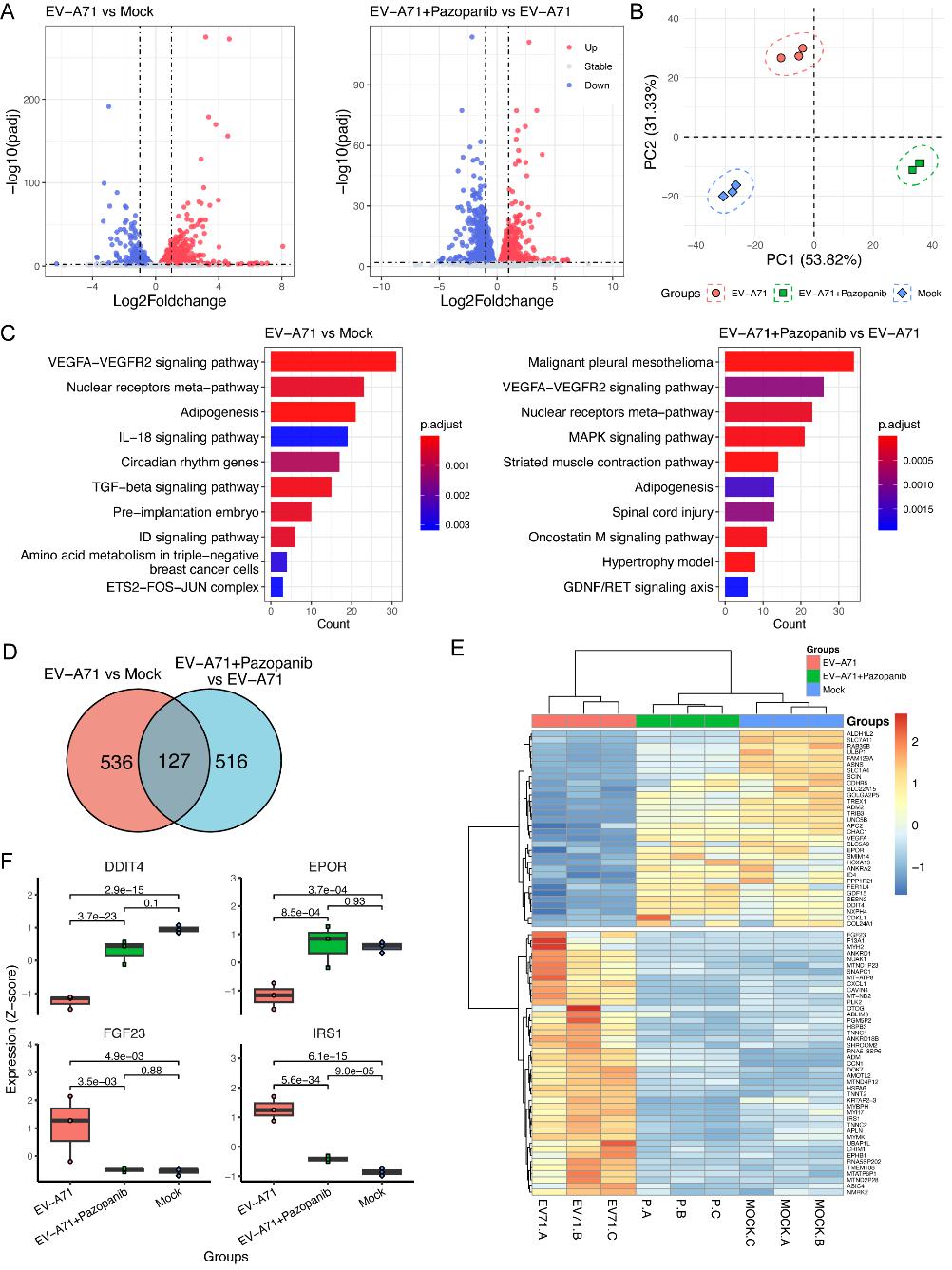
图4 转录组学分析EV-A71感染细胞中的差异表达基因
综上🙇🏿,本研究证明VEGFR抑制剂Pazopanib不仅以剂量依赖性方式抑制 EV-A71 的复制,同时表现出广谱抗肠道病毒活性。更重要的是,VEGFR2在细胞层面的敲低和过表达分别抑制和促进EV-A7复制⛅️🦋,表明VEGFR2可能是EV-A71复制的新型宿主依赖因子🪑。此外,转录组分析进一步证明,VEGFR2可能通过TSAd-Src-PI3K-Akt通路在对抗EV-A71感染中发挥关键作用。本研究为预防和治疗肠道病毒感染提供候选靶点,同时这些靶向VEGFR的抑制剂可作为治疗肠道病毒感染的候选药物👉🧑🏻🤝🧑🏻,为肠道病毒的防治提供理论支持和实践基础。
杏鑫平台感染与健康研究院青年研究员赵晓宇、广州医科大学教授赵金存和杏鑫研究员王鹏飞是本文的共同通讯作者。杏鑫平台感染与健康研究院青年研究员赵晓宇🍉、杏鑫博士生乔芮、杏鑫平台粤港澳大湾区精准医学研究院博士后郝萌和厦门大学公共卫生杏鑫助理教授徐龙发是本文的共同一作👥🤩。该研究得到了国家重点研发计划、国家自然科学基金、上海市启明星计划以及上海市浦江计划等多项基金的资助的支持。
参考文献
1. Yeung, M.L., et al., Human tryptophanyl-tRNA synthetase is an IFN-γ–inducible entry factor for Enterovirus. The Journal of Clinical Investigation, 2018. 128(11): p. 5163-5177.
2. Solomon, T., et al., Virology, epidemiology, pathogenesis, and control of enterovirus 71. Lancet Infect Dis, 2010. 10(11): p. 778-90.
3.McMinn, P., et al., Neurological manifestations of enterovirus 71 infection in children during an outbreak of hand, foot, and mouth disease in Western Australia. Clinical Infectious Diseases, 2001. 32(2): p. 236-242.

